投稿者:原澤 栄志(日本光電工業株式会社 取締役 専務執行役員)
METIS(医療技術産業戦略コンソーシアム)では医療機器研究開発の活性化のためには臨床現場のニーズを知り、研究を進めることが重要であるとの観点から、その環境整備に取り組んできました。
特に医療機関で臨床研究を行うに際してメーカーから未承認医療機器の提供を行うことが薬事法上問題ないか、また、医療機関が行う臨床研究もスムーズに行われるかなどの懸念があり、多くの企業、医療機関が躊躇していることがありました。
このような状態の解決に向けて、厚生労働省からは「臨床研究において用いられる未承認医療機器の提供等に係る薬事法の適用について」(平成22年3月31日)、その解釈のためのQ&A(平成23年3月31日)を示していただき、実際上の進め方についてはMETISが「未承認医療機器による臨床研究」として必要な手順等を示した「手引き」を作成(平成23年12月)することにしました。
研究者が未承認医療機器を企業から提供してもらうに際しての手続きや実施のフローチャートなどをわかりやすく解説して「手引き」としたものです。
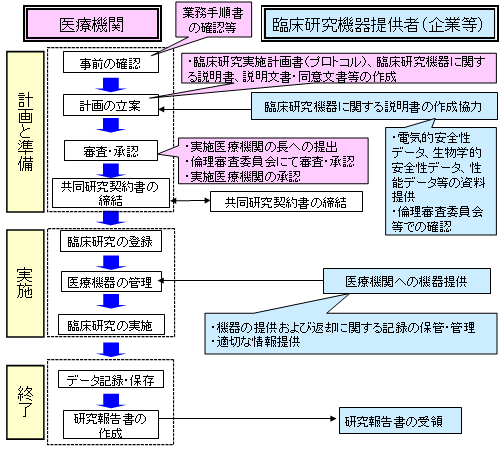
Figure.1 Flow Chart of Medical Devices Clinical Studies
この「手引き」の内容については活用いただくであろう関連学会、医療機関とも意見交換を行いましたが、研究後も残る医療機器の扱いについて、保守管理について、研究前に使用者等のトレーニングなど、「手引き」で医療従事者に周知する重要性が示されるとともに、医療機器のクラス分類や推定リスクの程度によって手続き内容等が異なることを背景説明を含めて十分にしてあることが医薬品との違いを理解するポイントになる、と評価していただきました。
「手引き」については、医機連のホームページ内のMETIS(手引き・ガイドブック)でご覧になることができます。ぜひ、ご活用ください。
→ 医機連サイト内 METISページ(手引き・ガイドブック)
この手引きが医療機器の研究の道案内となり、医療機器の開発がさらに活発となって医療の発展につながることを期待いたします。
更新日:2012/06/23